Termometria (I)
A sensação térmica constitui um critério impreciso para a medida da temperatura.
O termômetro é um sistema auxiliar que possibilita avaliar a temperatura de modo indireto.
Substância termométrica: substância que apresenta uma propriedade cuja medida varia com a temperatura.
No termômetro de mercúrio a substância termométrica é o mercúrio; a altura da coluna de mercúrio é a grandeza termométrica desse termômetro.
Função termométrica de um termômetro é a fórmula que relaciona os valores da grandeza termométrica com os valores da temperatura.
Pontos fixos: cujas temperaturas invariáveis no decorrer do tempo, medidas em sistemas que podem ser reproduzidos facilmente quando necessário.
Ponto de gelo: temperatura de fusão do gelo sob pressão normal (1 atm).
Ponto de vapor: temperatura de ebulição da água sob pressão normal (1 atm).
As escalas Celsius e Fahrenheit
Na escala Celsius, adotam-se os valores 0 ºC e 100 ºC para o ponto de gelo e para o ponto de vapor, respectivamente.
Na escala Fahrenheit, adotam-se os valores 32 ºF e 212 ºF para o ponto de gelo e para o ponto de vapor, respectivamente.
Conversão entre a temperatura Celsius (θC) e a temperatura Fahrenheit (θF)
Relação entre a variação de temperatura na escala Celsius (ΔθC) e na escala Fahrenheit (ΔθF)
A escala absoluta Kelvin
A escala absoluta Kelvin adota a origem no zero absoluto, estado térmico em que cessaria a agitação térmica. Sua unidade (kelvin: K) tem extensão igual à do grau Celsius (ºC).
Relação entre a temperatura Kelvin (T) e a Celsius (θC)
Relação entre as variações de temperatura
Exercícios básicos
Exercício 1
Ao tomar a temperatura de uma criança que está febril, a mãe utiliza um termômetro clínico graduado na escala Fahrenheit e anota a temperatura de 101,3 ºF. Qual é o valor da correspondente temperatura na escala Celsius
Exercício 2
Retome a situação descrita na questão anterior. Após medicar seu filho, decorrido certo tempo a mãe efetua uma nova medida da temperatura. Ela nota que houve uma redução de 2,7 ºF. Qual é a correspondente redução de temperatura na escala Celsius?
Exercício 3
Dois termômetros, um graduado na escala Celsius e outro na escala Fahrenheit, estão em equilíbrio térmico com um certo líquido. A temperatura indicada pelo termômetro graduado na escala Fahrenheit é dada por um número igual ao dobro daquele indicado pelo termômetro graduado na escala Celsius. Qual é esta temperatura na escala Celsius?
Exercício 4
Retome a situação descrita na questão anterior. O líquido no qual os termômetros estão imersos é gradativamente resfriado até uma temperatura para a qual os dois termômetros indicam o mesmo valor. Qual é a temperatura em questão?
Exercício 5
Pedro é um aluno que está iniciando o segundo ano do ensino médio. O professor Adalberto pede para que ele invente uma escala termométrica, medida em graus Pedro (ºP). Para isso Pedro atribui ao ponto do gelo a temperatura 10 ºP e para o ponto do vapor 90 ºP. Qual é a relação entre a temperatura na escala Celsius (θC) e a temperatura na escala Pedro (θP)?
Fonte : Os Fundamentos Da Física
Temperatura
Chamamos de Termologia a parte da física que estuda os fenômenos relativos ao calor, aquecimento, resfriamento, mudanças de estado físico, mudanças de temperatura, etc.
Temperatura é a grandeza que caracteriza o estado térmico de um corpo ou sistema.
Fisicamente o conceito dado a quente e frio é um pouco diferente do que costumamos usar no nosso cotidiano. Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é aquele que tem baixa agitação das suas moléculas.
Ao aumentar a temperatura de um corpo ou sistema pode-se dizer que está se aumentando o estado de agitação de suas moléculas.
Ao tirarmos uma garrafa de água mineral da geladeira ou ao retirar um bolo de um forno, percebemos que após algum tempo, ambas tendem a chegar à temperatura do ambiente. Ou seja, a água "esquenta" e o bolo "esfria". Quando dois corpos ou sistemas atingem o mesma temperatura, dizemos que estes corpos ou sistemas estão em equilíbrio térmico.
Fonte Só Física
Termometria (II)
As escalas Celsius e Fahrenheit
Na escala Celsius, adotam-se os valores 0 ºC e 100 ºC para o ponto de gelo e para o ponto de vapor, respectivamente.
Na escala Fahrenheit, adotam-se os valores 32 ºF e 212 ºF para o ponto de gelo e para o ponto de vapor, respectivamente.
Conversão entre a temperatura Celsius (θC) e a temperatura Fahrenheit (θF)
Na escala Celsius, adotam-se os valores 0 ºC e 100 ºC para o ponto de gelo e para o ponto de vapor, respectivamente.
Na escala Fahrenheit, adotam-se os valores 32 ºF e 212 ºF para o ponto de gelo e para o ponto de vapor, respectivamente.
Conversão entre a temperatura Celsius (θC) e a temperatura Fahrenheit (θF)
Relação entre a variação de temperatura na escala Celsius (ΔθC) e na escala Fahrenheit (ΔθF)
A escala absoluta Kelvin
A escala absoluta Kelvin adota a origem no zero absoluto, estado térmico em que cessaria a agitação térmica. Sua unidade (kelvin: K) tem extensão igual à do grau Celsius (ºC).
Relação entre a temperatura Kelvin (T) e a Celsius (θC)
Relação entre as variações de temperatura
Exercício 1:
O físico alemão Daniel Gabriel Fahrenheit* (1686-1736) construiu seus próprios termômetros e em 1714 passou a usar o mercúrio como substância termométrica. A escala que leva seu nome foi criada em 1724, adotando como “zero” uma mistura de gelo, água e sal de amônia e 96 para a temperatura do corpo humano. Posteriormente fez ajustes em sua escala, atribuindo os valores 32 e 212, respectivamente, para os pontos de congelamento e ebulição da água, sob pressão normal. Medidas mais precisas indicam que a temperatura média do corpo humano é da ordem de 98,6 ºF.As temperaturas de 0 ºF e 98,6 ºF correspondem, respectivamente, nas escalasCelsius* e Kelvin* aos valores:
a) -17,8 ºC e 310 K
b) -17,8 ºC e 371,6 K
c) -32 ºC e 273 K
d) 0 ºC e 318,6 K
e) 8 ºC e 37 K
Exercício 2:
Uma escala E adota os valores 15 °E para o ponto do gelo e 105 °E para o ponto do vapor. Qual é a indicação dessa escala que corresponde à temperatura de 72 °F?
Exercício 3:
A variação de temperatura de 108 °F equivale a:
a) 42 °C b) 84 °C c) 108 °C d) 60 K e) 333 K
Exercício 4:
A temperatura indicada por um termômetro graduado na escala Fahrenheit excede em duas unidades o triplo da indicação de outro termômetro graduado na escala Celsius. Qual é esta temperatura medida na escala Kelvin?
Exercício 5:
Antigamente foi usada uma escala absoluta, criada pelo engenheiro e físico escocêsWillian John Maquorn Rankine* (1820-1872), que adotava como unidade o grau Rankine (°Ra), cuja extensão era igual à do grau Fahrenheit (ºF) e que considerava o zero absoluto como 0 ºRa.
Determine:
a) a temperatura do zero absoluto na escala Fahrenheit;
b) a relação entre a temperatura absoluta Rankine (TR) e a temperatura Fahrenheit correspondente (θF);
c) os valores das temperaturas correspondentes ao ponto do gelo e ao ponto do vapor na escala absoluta Rankine.
Mudanças de fase (I)
Mudanças de fase ou estados de agregação
Clique para ampliar
Tipos de Vaporização
Evaporação: processo espontâneo e lento que ocorre na superfície do líquido.
Ebulição: processo no qual há formação tumultuosa de bolhas, ocorrendo em toda massa líquida. A ebulição se verifica a uma determinada temperatura (temperatura de ebulição) que depende da pressão exercida sobre a superfície do líquido. Por exemplo, a água entra em ebulição a 100 ºC sob pressão normal (1 atmosfera).
Lei da mudança de fase
Sob pressão constante, durante a mudança de fase a temperatura permanece constante.Calor latente (L)
Numericamente é a quantidade de calor que a substância troca (ganha ou perde), por unidade de massa, durante a mudança de estado, mantendo-se constante a temperatura.
Unidade: cal/g
Quantidade de calor trocada durante a mudança de estado por uma massa m de uma substância.
Q = m.L
Curva de aquecimento da água
Clique para ampliar
A: aquecimento do gelo
B: fusão do gelo a 0 ºC
C: aquecimento da água líquida
D: vaporização da água líquida a 100 ºC
E: aquecimento do vapor
Calor latente de fusão do gelo (Lf) e de vaporização da água (Lv)
Imaginemos uma certa quantidade de gelo a -20 ºC, ao nível do mar, sendo aquecido por uma fonte de calor constante. A temperatura do gelo sobe até atingir 0 ºC. Nessa condição começa o processo de fusão e o calor recebido é usado apenas para quebrar a cadeia cristalina, não havendo aumento de temperatura. Enquanto ocorre a fusão o gelo precisa de 80 calorias para cada grama, para ser transformado em água. Dizemos então que o calor latente de fusão do gelo Lf é igual a 80 cal/g.
Caso a massa de gelo, a 0 ºC, fosse igual a 100 g, para transformá-la em água seriam necessárias 8000 cal.
Q = m.Lf => Q = 100.80 => Q = 8000 cal
Uma vez transformada em água e continuando a receber calor, a massa que inicialmente era gelo terá a agitação térmica das moléculas aumentada até atingir a temperatura de ebulição (100 ºC) quando ocorre a vaporização. Para cada grama de água que passa para a fase gasosa (vapor) são necessárias 540 calorias. Dizemos então que o calor latente de vaporização da água, Lv é igual a 540 cal/g.
Para vaporizar 100 g de água a 100 ºC são necessárias 54000 cal.
Q = m.Lv => Q = 100. 540 => Q = 54000 cal
Exercícios básicos
Exercício 1:
Assinale as afirmativas corretas:I) A passagem de uma substância pura do estado sólido para o estado líquido recebe o nome de liquefação.
II) O gelo sofre fusão a 0 ºC sob pressão normal. Logo, sob pressão normal a água se solidifica a 0 ºC.
III) Sob mesma pressão a temperatura de ebulição de uma substância pura coincide com a temperatura de condensação dessa substância.
IV) Um estudante, após tomar um banho quente nota que o espelho do banheiro está recoberto de gotículas de água. A mudança de estado que explica este fato é a fusão.
Exercício 2:
Por que num dia frio, ao falarmos, sai “fumaça” de nossa boca?
Exercício 3:
Por convenção sabemos que uma quantidade de calor recebida por um corpo é positiva e a quantidade de calor cedida, é negativa. Analise a afirmação abaixo e indique se está correta ou incorreta:
Se o calor latente de fusão da água é +80 cal/g, então o calor latente de solidificação da água é –80 cal/g. Do mesmo modo, se o calor latente de vaporização da água é +540 cal/g, o calor latente de condensação da água é igual a –540 cal/g.
Exercício 4:
O gráfico abaixo apresenta a curva de aquecimento de uma substância pura de massa 100 g, inicialmente no estado sólido.
Clique para ampliar
Determine para esta substância:
a) A temperatura de fusão
b) A temperatura de ebulição
c) O calor latente de fusão
d) O calor latente de vaporização
e) O calor específico no estado sólido
f) O calor específico no estado líquido
g) O calor específico no estado de vapor
Exercício 5:
Um bloco de gelo de massa 200 g está a -10 ºC. Qual é a quantidade de calor necessária para se obter água a +10 ºC. Considere a pressão normal.
Dados:
Calor latente de fusão do gelo: 80 cal/g
Calor específico do gelo: 0,50 cal/g.ºC
Calor específico da água: 1,0 cal/g.ºC
Fonte: Os Fundamentos Da Física
Mudanças de fase (III)
Influência da pressão nas temperaturas de fusão e de ebulição
A maioria das substâncias aumenta de volume na fusão e, portanto, diminui de volume ao se solidificar. Para estas substâncias, um aumento de pressão acarreta um aumento na temperatura de fusão.
c) aumente
d) aumente e a seguir diminua
e) diminua e a seguir aumente
Exercício 3:
Você sabe que a água entra em ebulição a 100 ºC quando sob pressão normal (1 atm). É possível ferver a água à temperatura ambiente?
Exercício 4:
Analise a proposição abaixo e assinale se está certa ou errada.
"O ponto de ebulição da água é sempre 100 ºC em qualquer ponto da superfície terrestre, mesmo que ela esteja sendo fervida em recipientes abertos e em locais de altitudes diferentes".
Exercício 5:
Analise a proposição abaixo e assinale se está certa ou errada.
"Quando a água é aquecida numa panela de pressão fechada, a temperatura atingida é maior do que 100 ºC pois a pressão no interior da panela é maior do que 1 atm".
Exercício 6:
O diagrama de fases apresentado abaixo é de uma substância hipotética.
a) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 10 ºC?
b) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 30 ºC?
c) Qual é o nome da mudança de fase que ocorre quando a substância passa de B para A?
d) Qual é o nome da mudança de fase que ocorre quando a substância passa de D para E?
e) Em que fase a substância não poderá se encontrar se estiver submetida a uma pressão inferior à do ponto triplo T?
f) Sendo C o ponto crítico, é possível liquefazer a substância, por meio de uma compressão isotérmica, estando à temperatura de 70 ºC?
Fonte: Fundamentos de Física
Influência da pressão nas temperaturas de fusão e de ebulição
A maioria das substâncias aumenta de volume na fusão e, portanto, diminui de volume ao se solidificar. Para estas substâncias, um aumento de pressão acarreta um aumento na temperatura de fusão.
Clique para ampliar
Existem exceções, como por exemplo a água. Para estas substâncias o volume diminui na fusão e, portanto, aumenta na solidificação. Para as exceções, um aumento de pressão acarreta uma diminuição na temperatura de fusão.
Clique para ampliar
Para todas as substâncias, um aumento de pressão acarreta um aumento na temperatura de ebulição.
Clique para ampliar
Diagrama de fases
Maioria das substâncias (como por exemplo o CO2)
Clique para ampliar
Exceções (como por exemplo a água)
Clique para ampliar
Curva de fusão (1)
Delimita as regiões correspondentes às fases sólida e líquida. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Curva de vaporização (2)
Delimita as regiões correspondentes às fases líquida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Curva de sublimação (3)
Delimita as regiões correspondentes às fases sólida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Ponto triplo ou tríplice (T)
Estado comum às três curvas; é representativo do equilíbrio entre as três fases da substância.
Ponto crítico (C)
Estado em que corresponde à mais alta temperatura em que a substância é um vapor.
Vapor (θ ≤ θC): liquefaz-se por compressão isotémica.
Gás (θ > θC): não se liquefaz por compressão isotérmica.
Clique para ampliar
Exercícios básicos
Exercício 1:
Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
a) O volume da substância diminui com a solidificação.
b) Os estados sólido e líquido desta substância têm mesma densidade.
c) Para esta substância um aumento de pressão acarreta uma diminuição na temperatura de fusão.
d) Para esta substância um aumento de pressão acarreta um aumento na temperatura de fusão.
e) A temperatura de fusão desta substância é a mesma, qualquer que seja a pressão sobre ela exercida.
Exercício 2:
Um aumento da pressão sobre o gelo faz com que sua temperatura de fusão:
a) mantenha-se constante
b) diminuac) aumente
d) aumente e a seguir diminua
e) diminua e a seguir aumente
Exercício 3:
Você sabe que a água entra em ebulição a 100 ºC quando sob pressão normal (1 atm). É possível ferver a água à temperatura ambiente?
Exercício 4:
Analise a proposição abaixo e assinale se está certa ou errada.
"O ponto de ebulição da água é sempre 100 ºC em qualquer ponto da superfície terrestre, mesmo que ela esteja sendo fervida em recipientes abertos e em locais de altitudes diferentes".
Exercício 5:
Analise a proposição abaixo e assinale se está certa ou errada.
"Quando a água é aquecida numa panela de pressão fechada, a temperatura atingida é maior do que 100 ºC pois a pressão no interior da panela é maior do que 1 atm".
Exercício 6:
O diagrama de fases apresentado abaixo é de uma substância hipotética.
Clique para ampliar
b) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 30 ºC?
c) Qual é o nome da mudança de fase que ocorre quando a substância passa de B para A?
d) Qual é o nome da mudança de fase que ocorre quando a substância passa de D para E?
e) Em que fase a substância não poderá se encontrar se estiver submetida a uma pressão inferior à do ponto triplo T?
f) Sendo C o ponto crítico, é possível liquefazer a substância, por meio de uma compressão isotérmica, estando à temperatura de 70 ºC?
Fonte: Fundamentos de Física
Gases
Gases são fluidos no estado gasoso, a característica que o difere dos fluidos líquidos é que, quando colocado em um recipiente, este tem a capacidade de ocupa-lo totalmente. A maior parte dos elementos químicos não-metálicos conhecidos são encontrados no seu estado gasoso, em temperatura ambiente.
As moléculas do gás, ao se movimentarem, colidem com as outras moléculas e com as paredes do recipiente onde se encontram, exercendo uma pressão, chamada de pressão do gás.
Esta pressão tem relação com o volume do gás e à temperatura absoluta.
Ao ter a temperatura aumentada, as moléculas do gás aumentam sua agitação, provocando mais colisões.
Ao aumentar o volume do recipiente, as moléculas tem mais espaço para se deslocar, logo, as colisões diminuem, diminuindo a pressão.
Utilizando os princípios da mecânica Newtoniana é possível estabelecer a seguinte relação:
Onde:
p=pressão
m=massa do gás
v=velocidade média das moléculas
V=volume do gás.
Gás perfeito ou ideal
É considerado um gás perfeito quando são presentes as seguintes características:
- o movimento das moléculas é regido pelos princípios da mecânica Newtoniana;
- os choques entre as moléculas são perfeitamente elásticos, ou seja, a quantidade de movimento é conservada;
- não há atração e nem repulsão entre as moléculas;
- o volume de cada molécula é desprezível quando comparado com o volume total do gás.
Energia cinética de um gás
Devido às colisões entre si e com as paredes do recipiente, as moléculas mudam a sua velocidade e direção, ocasionando uma variação de energia cinética de cada uma delas. No entanto, a energia cinética média do gás permanece a mesma.
Novamente utilizando-se conceitos da mecânica Newtoniana estabelece-se:
Onde:
n=número molar do gás (nº de mols)
R=constante universal dos gases perfeitos (R=8,31J/mol.K)
T=temperatura absoluta (em Kelvin)
O número de mols do gás é calculado utilizando-se sua massa molar, encontrado em tabelas periódicas e através da constante de Avogadro.
Utilizando-se da relação que em 1mol de moléculas de uma substância há 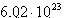 moléculas desta substância.
moléculas desta substância.
Transformação Isotérmica
A palavra isotérmica se refere a mesma temperatura, logo uma transformação isotérmica de uma gás, ocorre quando a temperatura inicial é conservada.
A lei física que expressa essa relação é conhecida com Lei de Boyle e é matematicamente expressa por:
Onde:
p=pressão
V=volume
Como esta constante é a mesma para um mesmo gás, ao ser transformado, é válida a relação:
Exemplo:
Certo gás contido em um recipiente de 1m³ com êmbolo exerce uma pressão de 250Pa. Ao ser comprimido isotérmicamente a um volume de 0,6m³ qual será a pressão exercida pelo gás?
Analogamente à transformação isotérmica, quando há uma transformação isobárica, a pressão é conservada.
Regida pela Lei de Charles e Gay-Lussac, esta transformação pode ser expressa por:
Onde:
V=volume;
T=temperatura absoluta;
Assim, quando um mesmo gás muda de temperatura ou volume, é válida a relação:
Exemplo:
Um gás de volume 0,5m³ à temperatura de 20ºC é aquecido até a temperatura de 70ºC. Qual será o volume ocupado por ele, se esta transformação acontecer sob pressão constante?
É importante lembrarmos que a temperatura considerada deve ser a temperatura absoluta do gás (escala Kelvin) assim, o primeiro passo para a resolução do exercício é a conversão de escalas termométricas:
Lembrando que:
Então:
Transformação Isométrica
A transformação isométrica também pode ser chamada isocórica e assim como nas outras transformações vistas, a isométrica se baseia em uma relação em que, para este caso, o volume se mantém.
Regida pela Lei de Charles, a transformação isométrica é matematicamente expressa por:
Onde:
p=pressão;
T=temperatura absoluta do gás;
Como para um mesmo gás, a constante 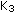 é sempre a mesma, garantindo a validade da relação:
é sempre a mesma, garantindo a validade da relação:
Exemplo:
Um gás que se encontra à temperatura de 200K é aquecido até 300K, sem mudar de volume. Se a pressão exercida no final do processo de aquecimento é 1000Pa, qual era a pressão inicial?
Fonte: Só Física
Gás ideal ou gás perfeito
No estudo do comportamento de um gás, consideramos o seguinte modelo:
• as moléculas do gás movimentam-se caoticamente;
• os choques entre as moléculas e contra as paredes do recipiente são perfeitamente elásticos;
• as moléculas não exercem forças entre si, exceto quando colidem;
• as moléculas apresentam volume próprio desprezível em comparação com o volume ocupado pelo gás.
O gás que obedece a este modelo é chamado gás perfeito ou gás ideal.
Um gás real submetido a altas temperaturas e baixas pressões apresenta um comportamento que se aproxima ao de um gás ideal.
Variáveis de estado
São as grandezas que caracterizam o estado de uma dada massa de gás perfeito:
Volume (V): o volume de um gás perfeito é o volume do recipiente que o contém.
Unidades: m3, litro (L), cm3.
Relações: 1 m3 = 1000 L, 1 m3 = 106 cm3, 1 L = 1000 cm3.
Pressão (p): a pressão de um gás perfeito resulta do choque de suas moléculas contra as paredes do recipiente que o contém. Sendo F a intensidade da força resultante que as moléculas exercem numa parede de área A, a pressão p é a grandeza escalar p = F/A.
Unidades: 1 pascal (Pa) = 1N/m2, atmosfera (atm); mmHg.
Relações: 1 atm = 105 Pa; 1 atm = 760 mmHg.
Temperatura (T): É a grandeza que mede o estado de agitação das moléculas do gás. No estudo dos gases utiliza-se a temperatura absoluta kelvin (K).
Transformações particulares
a) Isobárica: pressão p constante
Variam durante a transformação: o volume V e a temperatura T.
• Lei de Charles e Gay-Lussac da transformação isobárica:
Numa transformação isobárica, de uma determinada massa gasosa, o volume V e a temperatura T são diretamente proporcionais.
V = K.T ou V/T = K (constante)
• Mudança do estado V1, p e T1 para V2, p e T2
V1/T1 = V2/T2
• Gráfico V x T
Clique para ampliar
b) Isocórica: volume V constante.
Variam durante a transformação: a pressão p e a temperatura T.
• Lei de Charles e Gay-Lussac da transformação isocórica:
Numa transformação isocórica de uma determinada massa gasosa, a pressão p e a temperatura T são diretamente proporcionais.
p = K.T ou p/T = K (constante)
• Mudança do estado V, p1 e T1 para V, p2 e T2
p1/T1 = p2/T2
• Gráfico p x T
Clique para ampliar
c) Isotérmica: temperatura T constante
Variam durante a transformação: a pressão p e o volume V
• Lei de Boyle - Mariotte
Numa transformação isotérmica, de uma determinada massa gasosa, a pressão p e o volume V são inversamente proporcionais.
p = K/V ou p.V = K (constante)
• Mudança do estado V1, p1 e T para V2, p2, T
p1.V1 = p2.V2
• Gráfico p x V (hipérbole equilátera)
Clique para ampliar
Exercícios básicos
Exercício 1:
Um gás perfeito sofre uma transformação isobárica e seu volume varia de V1 para V2enquanto que sua temperatura varia de T1 para T2. Relacione as grandezas V1, V2, T1 e T2.
Exercício 2:
Um gás perfeito sofre uma transformação isocórica e sua pressão varia de p1 para p2enquanto que sua temperatura varia de T1 para T2. Relacione as grandezas p1, p2, T1 e T2.
Exercício 3:
Um gás perfeito sofre uma transformação isotérmica e sua pressão varia de p1 para p2 enquanto que seu volume varia de V1 para V2. Relacione as grandezas p1, p2, V1e V2.
Exercício 4:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a temperatura TB.
Exercício 5:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a pressão pB.
Exercício 6:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a pressão pA
Exercício 7:
Um gás perfeito sofre uma transformação cíclica ABCA, indicada no diagrama p x V.
Clique para ampliar
Classifique o tipo de transformação sofrida pelo gás nas etapas:
a) A para B
b) B para C
c) C para A
Fonte:http://fisicadonicolau.moderna.com.br/
Propagação do calor
A propagação do calor pode ocorrer por três processos diferentes: condução, convecção e irradiação. Para os três modos de propagação definimos a grandeza denominada fluxo de calor:
III) Os esquimós fazem suas casas, os iglus, com blocos de gelo, por que o gelo é um isolante térmico, mantendo o ambiente interno mais quente que o externo.
Tem-se:
a) Só a afirmação I) é correta;
b) Só as afirmações I) e II) são corretas;
c) Só as afirmações I) e III) são corretas;
d) Só as afirmações II) e III) são corretas;
e) Todas as afirmações são corretas.
Resolução: clique aqui
x
Exercício 2:
O calor específico da água é maior do que o calor específico da areia. Assim, durante o dia, numa região litorânea, a areia se aquece mais do que a água do mar. O ar aquecido acima da areia sobe e produz uma região de baixa pressão, aspirando o ar sobre o mar. Sopra a brisa marítima. Explique por que à noite o processo se inverte, isto é, sopra a brisa terrestre?
Resolução: clique aqui
x
Exercício 3:
Resolução: clique aqui
Exercício 5:
Duas barras de mesmo comprimento, mesma área de seção reta e constituídas de metais diferentes são soldadas e suas outras extremidades mantidas às temperaturas 100 ºC e 0 ºC. Despreze a perda de calor pela superfície lateral. Os coeficientes de condutibilidade térmica dos metais que constituem as barras do sistema são K1 e K2. A temperatura da junção é de 40 ºC. Qual é a relação entre K1 e K2?
Fonte: Fundamentos de Física
Óptica Geométrica
A Óptica Geométrica estuda a propagação da luz nos diferentes meios e os fenômenos que dela decorrem: a reflexão e a refração. Este estudo é feito a partir da noção de raio de luz e de princípios fundamentais.
Raios de luz. Feixe de luz
Para representar que a luz emitida pela chama de uma vela atinge a vista de um observador, utilizamos linhas orientadas que fornecem a direção e o sentido de propagação da luz. Tais linhas são chamadas raios de luz.
Um conjunto de raios de luz é chamado feixe de luz. Este pode ser convergente, divergente ou de raios paralelos.
Meios transparentes, translúcidos e opacos
Os meios através dos quais os objetos podem ser vistos nitidamente são chamados transparentes. Ao atravessar um meio transparente a luz percorre trajetórias regulares e bem definidas. O ar atmosférico existente numa sala e a água em camadas pouco espessas, são exemplos de meios transparentes.
Os meios através dos quais os objetos não podem ser vistos nitidamente são chamados translúcidos. O papel de seda e o vidro fosco são exemplos de meios translúcidos. Ao atravessar um meio translúcido a luz percorre trajetórias irregulares e indefinidas.
Os meios que não permitem que a luz os atravesse são chamados opacos. É o caso de uma parede de concreto.
Observação: Um meio é homogêneo quando apresenta as mesmas propriedades em todos os seus pontos.
A velocidade de propagação da luz
Todas as luzes, monocromáticas (isto é, luzes de uma só cor) ou policromáticas (luzes constituídas pela superposição de luzes de cores diferentes, como a luz solar branca) propagam-se no vácuo com a mesma velocidade que é aproximadamente igual a 3,0.105 km/s.
Nos meios materiais homogêneos e transparentes a velocidade de propagação da luz é menor que no vácuo e seu valor depende da cor da luz que se propaga. Num meio material, a luz monocromática vermelha apresenta a maior velocidade de propagação e a violeta, a menor. As luzes das demais cores apresentam velocidades de propagação intermediárias. Na ordem decrescente de velocidade: luz vermelha, alaranjada, amarela, verde azul, anil e violeta.
Ano-Luz
Um ano-luz é a distância que a luz percorre no vácuo durante um ano terrestre. Vamos transformar em quilômetros o comprimento equivalente a um ano-luz.
Sendo c = 3,0.105 km/s a velocidade de propagação da luz no vácuo e
Δt = 1 ano terrestre = 365,2 dias = 365,2.24.3600 s ≈ 3,16.107 s,
de d = c.Δt, vem:
1 ano-luz = 3,0.105 km/s.3,16.107 s
1 ano-luz ≈ 9,5.1012 km
Princípios da Óptica Geométrica
a) Princípio da propagação retilínea
Nos meios homogêneos e transparentes a luz se propaga em linha reta
b) Princípio da independência dos raios de luz
Quando raios de luz se cruzam, cada um segue sua propagação como se os outros não existissem
Observações: As leis da reflexão e refração são consideradas princípios no estudo da Óptica Geométrica. Estas leis serão analisadas nos próximos capítulos.
Como decorrência dos princípios anteriores, podemos enunciar a reversibilidade da luz:
A trajetória seguida pela luz, não depende do sentido de propagação
Exercícios básicos
Exercício 1:
Analise as afirmações abaixo e indique as corretas:
a) O ar atmosférico de uma sala é um meio transparente.
b) A água em camadas espessas é um meio transparente.
c) O vidro fosco é um meio translúcido.
d) A atmosfera terrestre, cuja densidade diminui com o aumento da altitude, é um meio homogêneo.
e) Nos meios transparentes e translúcidos a luz se propaga em linha reta.
Exercício 2:
Um ano-luz tem a dimensão de:
a) tempo; b) velocidade; c) aceleração; d) comprimento; e) energia.
Exercício 3:
Uma estrela está situada a 4 anos-luz da Terra. Qual a distância entre a estrela e a Terra em quilômetros?
Exercício 4:
O holofote A ilumina o artista situado no lado direito. Desliga-se A e liga-se o holofote B iluminando o artista situado no lado esquerdo. A seguir, ligam-se os dois holofotes e os feixes se cruzam. Os artistas ficam iluminados? Em que princípio da Óptica Geométrica você baseou sua resposta?
Exercício 5:
Tem-se uma associação de espelhos planos. Um raio de luz incide no espelho E1 e segue a trajetória ABCD, emergindo do espelho E2.
Represente a trajetória da luz que incide no espelho E2, segundo o raio DC. Em que fato da Óptica Geométrica você baseou sua resposta?
Propagação do calor
Fluxo de calor
A propagação do calor pode ocorrer por três processos diferentes: condução, convecção e irradiação. Para os três modos de propagação definimos a grandeza denominada fluxo de calor:
Em que Q é a quantidade de calor transmitida e Δt o intervalo de tempo correspondente.
Unidades de fluxo de calor: cal/s, cal/min, W (watt)
Condução térmica
Transmissão em que a energia térmica se propaga por meio da agitação molecular.
Clique para ampliar
Lei de Fourier:
Em que K é o coeficiente de condutibilidade térmica do material.
Clique para ampliar
Os bons condutores, como os metais, têm valor elevado para a constante K; já os isolantes térmicos (madeira, isopor, lã, etc.) têm valor baixo para a constante K.
Convecção térmica
Transmissão de energia térmica, que ocorre nos fluidos, devido à movimentação do próprio material aquecido, cuja densidade varia com a temperatura.
Correntes de convecção
Ascendente, formada por fluido quente.
Descendente, formada por fluido frio.
Clique para ampliar
Irradiação
Transmissão de energia por meio de ondas eletromagnéticas (ondas de rádio, luz visível, ultravioleta etc.). Quando estas ondas são raios infravermelhos, falamos emirradiação térmica.
Quando a energia radiante (energia que se propaga por meio de ondas eletromagnética) atinge a superfície de um corpo ela é parcialmente absorvida, parcialmente refletida e parcialmente transmitida através do corpo. A parcela absorvida aumenta a energia de agitação das moléculas constituintes do corpo (energia térmica). As radiações infravermelhas são as mais facilmente absorvidas, isto é, são as que mais facilmente se transformam em energia térmica.
Efeito estufa
Substâncias presentes na atmosfera terrestre (CO2, vapor de água, metano, etc.) limitam a transferência de calor da Terra para o espaço, durante a noite, mantendo assim um ambiente adequado para a vida. A intensificação desse efeito, devido à ação humana, está provocando o aquecimento global, com graves consequências para o planeta.
Garrafa térmica
Dispositivo no qual são minimizados os três processos de transmissão de calor. O vácuo entre as paredes duplas evita a condução. A boa vedação da garrafa evita a convecção. O espelhamento interno e externo das paredes reduz ao mínimo a irradiação.
Clique para ampliar
Exercício básicos
Exercício 1:
Considere as afirmações:
I) As paredes das garrafas térmicas são espelhadas para que evitem a transmissão de calor por condução térmica.
II) Ao colocarmos a mão próxima à base de um ferro elétrico quente, sentimos a mão “queimar”. Isto acontece pois a transmissão de calor entre o ferro e a mão ocorre principalmente por irradiação térmica.
III) Os esquimós fazem suas casas, os iglus, com blocos de gelo, por que o gelo é um isolante térmico, mantendo o ambiente interno mais quente que o externo.
Tem-se:
a) Só a afirmação I) é correta;
b) Só as afirmações I) e II) são corretas;
c) Só as afirmações I) e III) são corretas;
d) Só as afirmações II) e III) são corretas;
e) Todas as afirmações são corretas.
Resolução: clique aqui
x
Exercício 2:
O calor específico da água é maior do que o calor específico da areia. Assim, durante o dia, numa região litorânea, a areia se aquece mais do que a água do mar. O ar aquecido acima da areia sobe e produz uma região de baixa pressão, aspirando o ar sobre o mar. Sopra a brisa marítima. Explique por que à noite o processo se inverte, isto é, sopra a brisa terrestre?
Resolução: clique aqui
x
Exercício 3:
Por que os pássaros eriçam as penas quando está frio?
x
Resolução: clique aqui
Exercício 4:
Uma extremidade de uma barra de ferro está em contato com vapor de água em ebulição sob pressão normal (100 ºC). A outra extremidade está em contato com gelo em fusão sob pressão normal (0 ºC).
A barra tem comprimento L e área de seção reta A. Despreze o calor perdido pela superfície lateral. Seja Φ1 o fluxo de calor que atravessa a barra.
Corta-se a barra ao meio e os dois pedaços são soldados. Mantém-se as extremidades às temperaturas de 100 ºC e 0 ºC. Seja Φ2 o fluxo de calor que atravessa o novo sistema assim formado. Qual é a razão entre Φ1 e Φ2?
Clique para ampliar
Resolução: clique aqui
Exercício 5:
Duas barras de mesmo comprimento, mesma área de seção reta e constituídas de metais diferentes são soldadas e suas outras extremidades mantidas às temperaturas 100 ºC e 0 ºC. Despreze a perda de calor pela superfície lateral. Os coeficientes de condutibilidade térmica dos metais que constituem as barras do sistema são K1 e K2. A temperatura da junção é de 40 ºC. Qual é a relação entre K1 e K2?
Clique para ampliar
Resolução: clique aqui
Fonte: Fundamentos de Física
Óptica Geométrica
A Óptica Geométrica estuda a propagação da luz nos diferentes meios e os fenômenos que dela decorrem: a reflexão e a refração. Este estudo é feito a partir da noção de raio de luz e de princípios fundamentais.
Raios de luz. Feixe de luz
Para representar que a luz emitida pela chama de uma vela atinge a vista de um observador, utilizamos linhas orientadas que fornecem a direção e o sentido de propagação da luz. Tais linhas são chamadas raios de luz.
Um conjunto de raios de luz é chamado feixe de luz. Este pode ser convergente, divergente ou de raios paralelos.
Meios transparentes, translúcidos e opacos
Os meios através dos quais os objetos podem ser vistos nitidamente são chamados transparentes. Ao atravessar um meio transparente a luz percorre trajetórias regulares e bem definidas. O ar atmosférico existente numa sala e a água em camadas pouco espessas, são exemplos de meios transparentes.
Os meios através dos quais os objetos não podem ser vistos nitidamente são chamados translúcidos. O papel de seda e o vidro fosco são exemplos de meios translúcidos. Ao atravessar um meio translúcido a luz percorre trajetórias irregulares e indefinidas.
Os meios que não permitem que a luz os atravesse são chamados opacos. É o caso de uma parede de concreto.
Observação: Um meio é homogêneo quando apresenta as mesmas propriedades em todos os seus pontos.
A velocidade de propagação da luz
Todas as luzes, monocromáticas (isto é, luzes de uma só cor) ou policromáticas (luzes constituídas pela superposição de luzes de cores diferentes, como a luz solar branca) propagam-se no vácuo com a mesma velocidade que é aproximadamente igual a 3,0.105 km/s.
Nos meios materiais homogêneos e transparentes a velocidade de propagação da luz é menor que no vácuo e seu valor depende da cor da luz que se propaga. Num meio material, a luz monocromática vermelha apresenta a maior velocidade de propagação e a violeta, a menor. As luzes das demais cores apresentam velocidades de propagação intermediárias. Na ordem decrescente de velocidade: luz vermelha, alaranjada, amarela, verde azul, anil e violeta.
Ano-Luz
Um ano-luz é a distância que a luz percorre no vácuo durante um ano terrestre. Vamos transformar em quilômetros o comprimento equivalente a um ano-luz.
Sendo c = 3,0.105 km/s a velocidade de propagação da luz no vácuo e
Δt = 1 ano terrestre = 365,2 dias = 365,2.24.3600 s ≈ 3,16.107 s,
de d = c.Δt, vem:
1 ano-luz = 3,0.105 km/s.3,16.107 s
1 ano-luz ≈ 9,5.1012 km
Princípios da Óptica Geométrica
a) Princípio da propagação retilínea
Nos meios homogêneos e transparentes a luz se propaga em linha reta
b) Princípio da independência dos raios de luz
Quando raios de luz se cruzam, cada um segue sua propagação como se os outros não existissem
Observações: As leis da reflexão e refração são consideradas princípios no estudo da Óptica Geométrica. Estas leis serão analisadas nos próximos capítulos.
Como decorrência dos princípios anteriores, podemos enunciar a reversibilidade da luz:
A trajetória seguida pela luz, não depende do sentido de propagação
Exercícios básicos
Exercício 1:
Analise as afirmações abaixo e indique as corretas:
a) O ar atmosférico de uma sala é um meio transparente.
b) A água em camadas espessas é um meio transparente.
c) O vidro fosco é um meio translúcido.
d) A atmosfera terrestre, cuja densidade diminui com o aumento da altitude, é um meio homogêneo.
e) Nos meios transparentes e translúcidos a luz se propaga em linha reta.
Exercício 2:
Um ano-luz tem a dimensão de:
a) tempo; b) velocidade; c) aceleração; d) comprimento; e) energia.
Exercício 3:
Uma estrela está situada a 4 anos-luz da Terra. Qual a distância entre a estrela e a Terra em quilômetros?
Exercício 4:
O holofote A ilumina o artista situado no lado direito. Desliga-se A e liga-se o holofote B iluminando o artista situado no lado esquerdo. A seguir, ligam-se os dois holofotes e os feixes se cruzam. Os artistas ficam iluminados? Em que princípio da Óptica Geométrica você baseou sua resposta?
Exercício 5:
Tem-se uma associação de espelhos planos. Um raio de luz incide no espelho E1 e segue a trajetória ABCD, emergindo do espelho E2.
Represente a trajetória da luz que incide no espelho E2, segundo o raio DC. Em que fato da Óptica Geométrica você baseou sua resposta?









































